本报讯 10月10日至15日,我校细胞动力学教育部重点实验室张凯铭团队在解析Lon蛋白酶的完整三维结构并揭示其底物识别与转移的分子机制取得重要进展,与台湾中央研究院张崇毅团队在期刊JBC和Sciences Advances合作连续发表论文。
Lon AAA+蛋白酶(LonA)是一种在原核生物和真核生物细胞器中保守的ATP依赖性蛋白酶。LonA组装为同源六聚体,每个单体都包含一个N端结构域、一个中间ATP酶结构域和一个C端蛋白酶结构域。
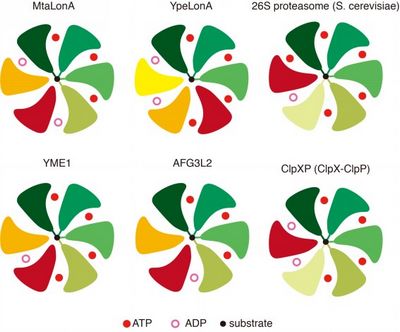
图为AAA+蛋白酶与底物结合的核苷酸结合状态比较。顶部视图显示了核苷酸和底物的结合状态。与底物结合的原体呈不同深浅的绿色。
10月10日,张凯铭和张崇毅团队合作在期刊JBC发表文章。张凯铭课题组李珊珊等解析了Meiothermus taiwanensis Lon底物结合状态的3.6-Å冷冻电镜结构,发现ATPase结构域的双孔环介导底物相互作用,由处于不同ATP结合和水解状态的四个连续单体以螺旋梯状排列,揭示了其通过LonA特异性变构实现持续性旋转易位的分子机制。
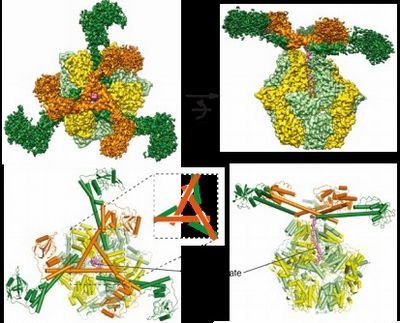
全长Lon的冷冻电镜结构解析。
10月15日,合作团队在期刊Sciences Advances继续发表延续性工作。张凯铭课题组李珊珊等利用冷冻电镜进一步解析了Meiothermus taiwanensis Lon底物结合状态的完整三维结构,分辨率达2.4 Å。这些结构显示了一个具有张拉整体三角形复合体的多层结构,独特地由六个长N端螺旋构成。相互锁定的螺旋三角形组装在六聚体核心的顶部,以展开一个由六个球状底物结合域组成的网。该研究成果为理解Lon和其他具有类似活性的AAA+蛋白酶的结构机制提供了一个完整的框架。
斯坦福大学Wah Chiu院士为此工作提供了宝贵意见。我校为第一完成单位,生医部李珊珊副研究员为第一作者,张凯铭、张崇毅研究员为共同通讯作者。
(细胞动力学教育部重点实验室 微尺度研究中心 生医部)